|
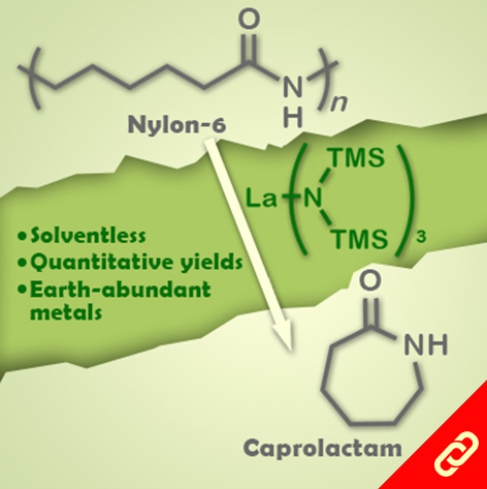
威士忌(Whisky)是一種以發酵穀物製成的酒精飲料且通常置於木桶中熟成。以國際貿易世界排名第一(45億英鎊)的蘇格蘭威士忌為例,它需要在橡木桶中至少熟成3年。威士忌的風味主要來自於「同源物(congeners)」,這是一種由酒與木桶的木質素(lignin)發生醇解(alcoholysis)反應而生成的化學物質。當威士忌在木桶中的熟成反應不完全,其呈現出來的風味將差強人意,因此,就得繼續把威士忌存於木桶中讓它繼續熟成。目前測量熟成度的傳統方法就是直接用鼻子聞和嘴巴喝,但是這會受到品酒員各自的主觀意識強烈影響,所以該傳統方法所得出的熟成度是沒有公信力的。 那有沒有辦法透過科學方法來測量威士忌的熟成度呢?答案肯定是有的。科學家曾利用氣相層析(GC)、核磁共振(1H NMR)及高效液相層析(HPLC)來測量威士忌樣品中同源物的多寡。但是,小型釀酒廠或傳統酒倉並沒有辦法負擔這些價格高昂的科學儀器,因此,如果有成本較低廉的測量方法,對釀酒商們來說是一大福音。近日,有研究團隊發展了一種使用金鹽(HAuCl4)來測量威士忌的熟成度的新方法。根據熟成度(同源物多寡)的不同溶液將呈現黃色(同源物少)至粉紅色(同源物多),其原因為同源物會還原金離子(Au3+)而形成金奈米顆粒,又因奈米金會吸收綠光,所以會讓溶液看起來偏紅。 由於這些奈米顆粒能夠在短短幾分鐘內就被生成,研究團隊表示這項技術可以快速且低成本的幫助酒廠清楚地知道哪些木桶中的威士忌已經熟成完全。該研究團隊甚至發現,不同的同源物會影響奈米金顆粒的大小、形狀及形成速度,因此也可以透過該技術鑑定威士忌中特定化合物的濃度。最後,William J. Peveler(該研究的領導者)提到:「此測量法雖然無法完全取代測試員的工作,但是能使他們的工作輕鬆許多。」 |
|
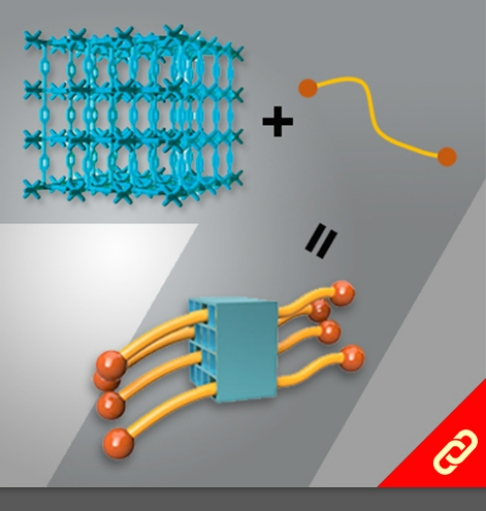
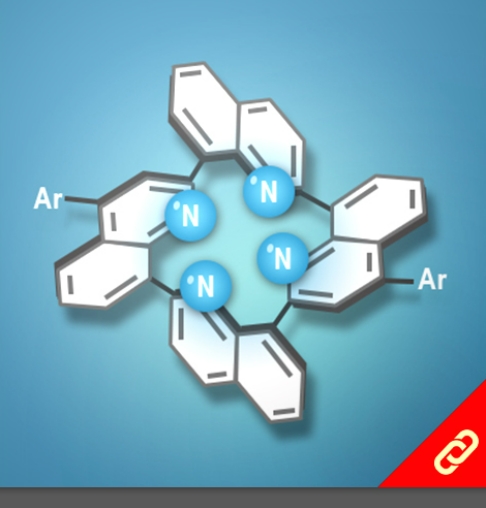
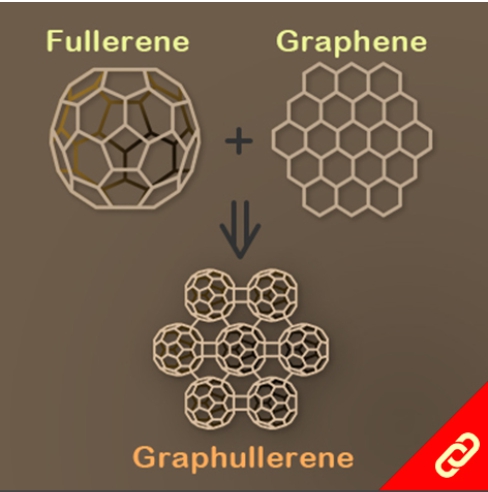
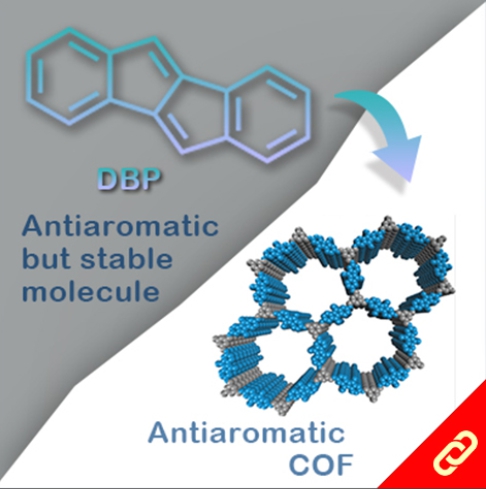
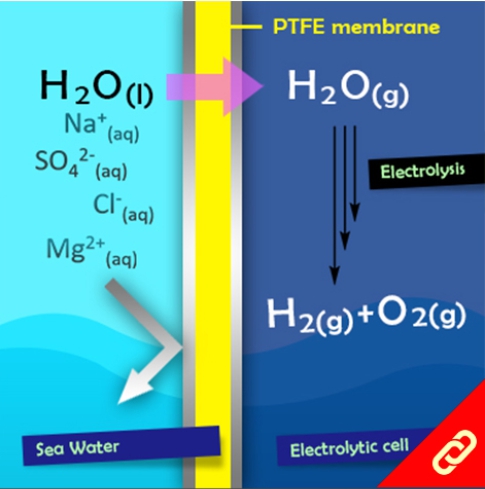
光合作用是利用光能把水、二氧化碳或硫化氫等無機物轉變成可以儲存化學能的有機物。植物會在細胞膜上的反應中心把光能轉換成化學能,且每個反應中心通常有100-800個吸收光能的葉綠素,此外每次的吸收都會發生電子激發能量轉移(EET, electronic excitation energy transfer),上述就是一個完整的光收集系統 (light-harvesting system)。目前被研究最多的光收集系統是紫色細菌的光收集系統1 (LH1)和光收集系統2 (LH2),因此,該研究將重點聚焦在以人工設計的化學分子模擬光收集系統2中的環型分子—由18個葉綠素分子組合而成的化合物 (B850) 。該化合物有著極快的環內EET (<200 fs),意思就是它可以在不到200 fs的時間內輸送一連串的能量。 目前化學家們雖然已成功開發數個以卟啉(又稱紫質,porphyrin)為基本單位的環型分子,但它們傳輸能量的速度都比其天然類似物慢很多。直到最近,該研究團隊成功合成出了接近天然物傳輸能量速度 (~350 fs) 的卟啉環分子,該分子包含了24個卟啉及1個丁二炔且具有封閉的共軛結構,其合成方法是以線形的卟啉串且兩端為炔烴的分子為起始物透過鈀催化劑將炔烴連接起來以形成環狀分子。該研究團隊表示,該分子環能有如此高速的能量傳輸速度原因有二:(1) 該環具有封閉的共軛結構、(2) 該環的直徑與天然版本的環相似 (~6 nm)。 |
|
|
|
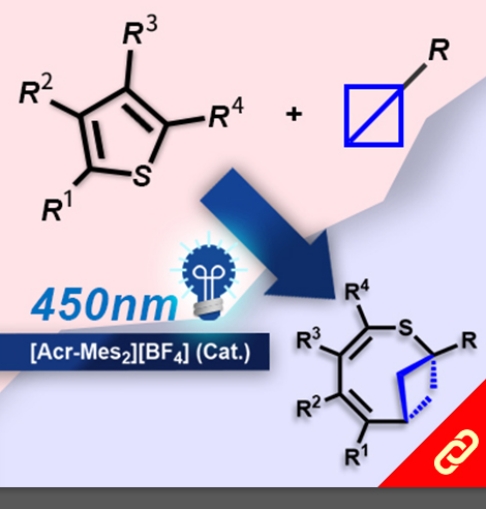
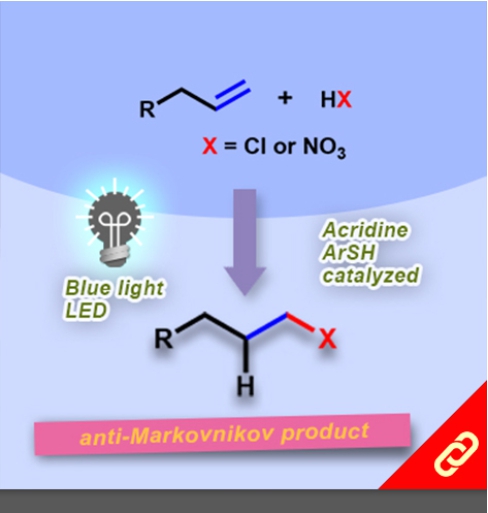
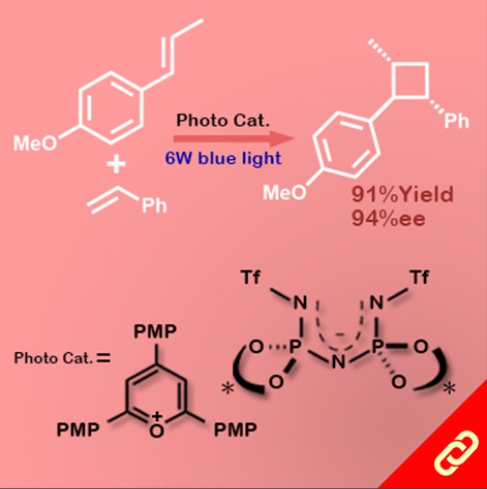
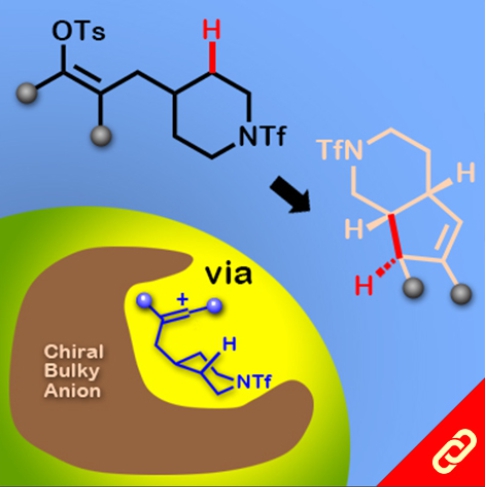
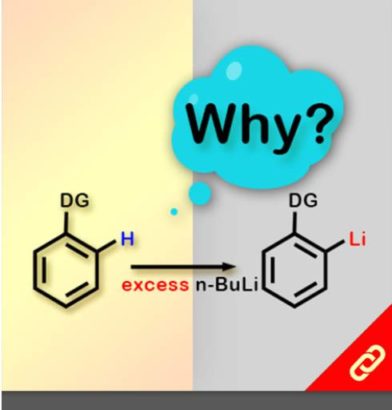
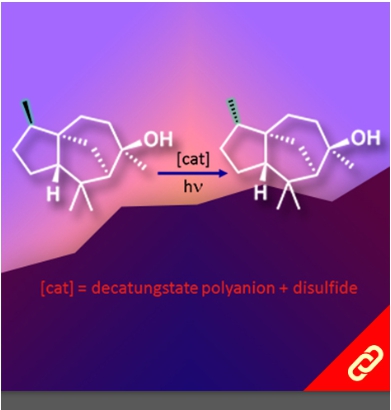
掌性分子的立體構形深深影響其化學性質,即只要一發生立體構形轉變(從R變成S或從S變成R)就可以使藥物、香料等不同掌性分子帶來巨大的差別。例如,改變單個取代基的立體化學就可以使有玫瑰香氣的化學分子轉變成具有薄荷味的分子。然而,要透過一步合成就轉變分子立體構形難如登天。化學家們通常得再從最基本的起始物重新合成,才能得到另一種構形的掌性分子。 近日,麻省理工學院的Alison E. Wendlandt及其團隊成功研究出只靠一步合成就能切換掌性分子的構型的方法。他們以癸鎢酸鹽(decatungstate polyanion)和助催化劑(cocatalyst)二硫化物來進行光催化反應(光源為390 nm LED)就有辦法改變掌性三級碳的立體構形,而且該反應條件是非常溫和的。 該研究團隊提出其反應機制是透過照光生成癸鎢酸鹽自由基陰離子,接著該自由基陰離子去拔掉掌性分子中三級碳上的氫,然後一個氫原子再接回三級碳上,就能成功改變了掌性分子的構形。該團隊也發現這項反應方法也可以應用在合成含有多種官能基的掌性分子上,因此,此項方法可以讓化學家們隨時切換較複雜的、合成序列上較後期的(late-stage)掌性分子的立體構形。最後Wendlandt表示「我們只需要一個或幾個步驟就可以轉換立體構形,此舉將極大地擴大掌性分子的應用範圍。」
|
|
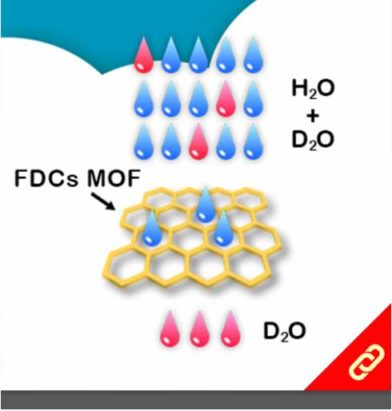
「單」分子記憶體的發明,可以使我們日常生活中常用到的「記憶裝置」(例如硬碟、隨身碟等等)變得更小、更薄且降低能耗。那什麼樣的化學分子才具備記憶功能呢?答案是自旋交叉錯合物(Spin-crossover complex, SCO)。這些過渡金屬錯合物可以透過外部刺激(溫度、光、壓力、磁場等等)在高自旋狀態(High-spin state)和低自旋狀態(Low-spin state)之間自由轉換,因此,這類分子在固態擁有磁滯現象 (Thermal hysteresis loop),即使得它們有磁記憶效應且可用作數據儲存。然而,目前所研發出的SCO只有辦法在非常低溫的環境下才能展現出磁滯效應(目前能表現出磁滯效應的最高記錄溫度為80 K),以致於分子記憶體無法在我們的日常生活中廣泛地被應用。 近日,西班牙的塔拉戈納加泰羅尼亞化學研究所的團隊研發出一種鐵三唑 (Triazole) 陰離子錯合物,它可以在室溫下以「單分子」的形態展現出磁滯效應,該團隊也發現此分子就算是在缺乏緊密排列的溶液態或者在只有5%鐵錯合物的固體中也都能在常溫中表現出磁滯現象。這一發現打破了既有的理論,即需要在固體裡讓分子與分子緊密排列而產生交互作用,進而才能發生磁滯效應。 研究團隊提出,該錯合物在室溫時,原子會重新排列,帶負電的基團在空間中會互相分離,這賦予該分子在室溫下也能展現出磁滯效應,除此之外,該錯合物的陰離子與陰離子之間產生的氫鍵也賦予了雙穩態性。該研究團隊指出室溫單分子記憶體將為數據儲存創造新的可能性,這將減少空間使用和能源消耗。 |